| Développement d’outils de microfluidique pour étudier les mécanismes de vieillissement chez la levure
Sous la direction de Gilles Charvin, Biophysique de la cellule unique – IGBMC, Strasbourg, France // Avril-Août 2011 Les cellules de levure du boulanger se divisent asymétriquement. On peut donc identifier une mère de sa fille nouvellement formée, cette dernière étant plus petite. Chaque mère produit un nombre limité de filles (env. 25) avant d’entrer dans un processus de sénescence puis de finir par mourir. De façon remarquable, même les filles de mères agées naissent avec un potentiel réplicatif (RLS) intact (RLS; nombre total de divisions cellulaires). Ainsi, il existe un mécanisme de réjuvénation qui permet d’éviter la sénescence clonale. Bien que l’effet de nombreuses mutations sur le RLS soit connu, les causes précises des mécanismes de sénescence et de réjuvénation et donc leur héritabilité sont très mal comprises. Au laboratoire, nous avons développé un système de microfluidique pour mesurer la dynamique de division cellulaire et suivre, pour la première fois au monde, une unique cellule de sa naissance jusqu’à sa mort ! Grâce à ce système, nous pouvons ainsi espérer mieux comprendre les mécanismes de sénescence et de réjuvénation. Si ce thème vous intéresse, n’hésitez pas à vous rendre dans la rubrique « Publications » Image (droite): Système micrométrique de microfluidique nommé CLiC permettant de piéger une cellule mère de sa naissance jusqu’à sa mort. En bas, les cellules prolifèrent et colonisent le système CLiC. Barre d’échelle : 5µm. |
 |
Ablations laser dans l’aile de pupe de Drosophile
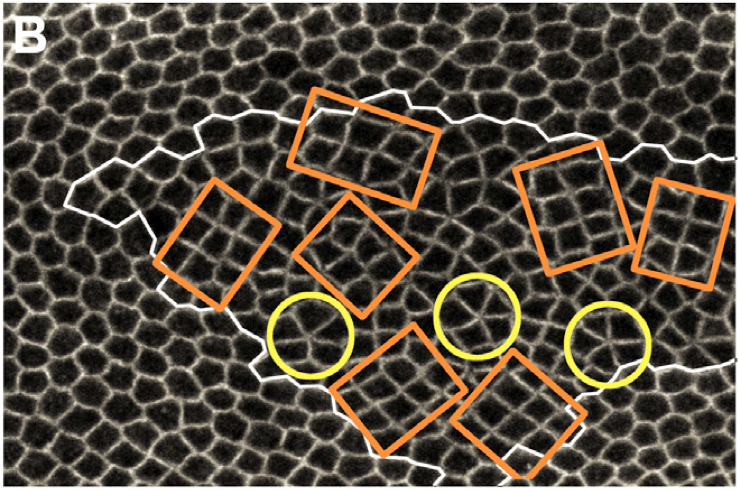
Planar cell rearrangements control epithelial tissue morphogenesis and cellular pattern formation. They lead to the formation of new junctions whose length and stability determine the cellular pattern of tissues. Here, we show that during Drosophila wing development the loss of the tumor suppressor PTEN disrupts cell rearrangements by preventing the lengthening of newly formed junctions that become unstable and keep on rearranging. We demonstrate that the failure to lengthen and to stabilize is caused by the lack of a decrease of Myosin II and Rho-kinase concentration at the newly formed junctions. This defect results in a heterogeneous cortical contractility at cell junctions that disrupts regular hexagonal pattern formation. By identifying PTEN as a specific regulator of junction lengthening and stability, our results uncover how a homogenous distribution of cortical contractility along the cell cortex is restored during cell rearrangement to control the formation of epithelial cellular pattern.Picture (right): Drosophila wing ephithelium. The tumor suppressor PTEN was disrupted in cells inside the white contour. Such mutant cells rearrange into chocolate bars (cobblestone – orange contours) or rosettes (yellow contours). During this internship, I probed the tension of cellular junctions in wild type cells (outside the white contour) and PTEN mutant cells and established that there is no difference of tension in PTEN mutant cells and wild type cells. |
 |
Biomimétisme des diatomés
Sous la direction de Christian Grillet, CUDOS, Université de Sydney, Australie // Mai-Juillet 2010 Les diatomés sont des algues dont les coquilles de verre peuvent présenter des structures périodiques. Ainsi, elles pourraient théoriquement se comporter comme des cristaux photoniques. Le but de ce stage était de développer des outils afin de caractériser les nano-structures des diatomés, de mesurer leurs propriétés photoniques, et de comparer ces résultats expérimentaux avec les prédictions théoriques et simulées. Pour cette étude, nous avons choisi l’espèce Coscinodiscus walesii. J’ai pu caractériser la structure de ce diatomé en analysant des images de microscopie optique et électronique. J’ai également simulé leur comportement à l’aide du logiciel RSoft et obtenu une strucure de bandes caractéristique d’un réseau périodique. Pour finir, j’ai mis en place deux montages expérimentaux permettant de mesurer les propriétés photoniques des diatomés. Le premier basé sur fibre optique en fuseau pour mesurer le couplage evanescent. En accord avec les simulations, aucun couplage n’a été observé. Le second basé sur un laser à incidence normale dans le but d’observer dans quelle mesure les diatomés se comportaient comme des micro-lentilles. Image (droite): Diatomé Coscinodiscus walesii observé au microscope. Grâce à son réseau hexagonal de trous de silice, cette algue marine se comporte comme une micro-lentille ! |
 |
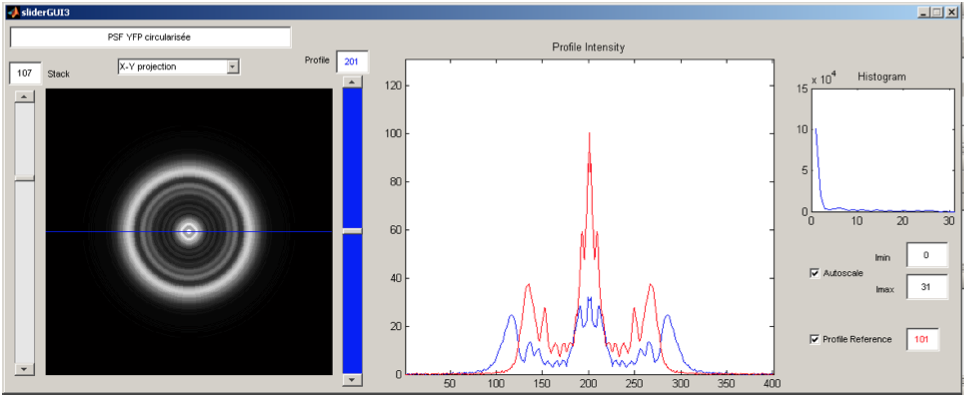
Mesure du rapport nucléo-cytoplasmique par microscopie de déconvolution
Sous la direction de Gilles Charvin, Biophysique de la cellule unique – ENS Lyon, France // Juin-Juillet 2009 Les mécanismes sous-jacents au contrôle de la taille de la cellule de levure et de ses organelles sont très étudiés dans le domaine de la biologie cellulaire, mais restent en grande partie inconnus. Cependant, le contrôle de l’évolution de ces tailles est essentiel pour le bon focntionnement du cycle cellulaire. Au cours de ce stage de deux mois, j’ai évalué le rapport nucléo-cytoplasmique (rapport entre le volume du noyau et celui de la cellule) par mesure directe des volumes nucléaires et cellulaires. J’ai pour cela utilisé un algorithme de déconvolution développé par mes soins appliqué à des images de microscopie de fluorescence en chap large à trois dimensions. Ces mesures ont été faites sur des cellules uniques, permettant ainsi une analyse time-lapse du cycle cellulaire. Image (droite): Interface Graphique développée pour l’analyse de Point Spread Function (PSF). |
 |